La termología (termo = calor, logia = estudio) es la parte de la física que estudia el calor y sus efectos sobre la materia. Ella es el resultado de una acumulación de descubrimientos que el hombre ha hecho desde la antigüedad, atingiendo su clímax en el siglo XIX gracias a científicos como Joule, Carnot, Kelvin y muchos otros.
TEMPERATURA
Las partículas constituyentes de los cuerpos están en continuo movimiento. Entendemos como temperatura la grandeza que mide el estado de agitación de las partículas de un cuerpo, caracterizando su estado térmico.
La temperatura es una magnitud escalar que mide la cantidad de energía térmica que tiene un cuerpo. En el caso de los gases su valor es proporcional a la energía cinética media de las moléculas, según la expresión:
Donde:
- Temperatura T: Su unidad de medida en el Sistema Internacional es el Kelvin ( K )
- Constante universal k: Se trata de una constante igual para todos los gases. Su unidad de medida en el Sistema Internacional es el Kelvin partido Julio ( K/J )
- Energía cinética promedio de las moléculas del gas <Ec>: Se trata del valor medio de energía cinética de las moléculas del gas. Su unidad de medida en el Sistema Internacional es el Julio ( J )
¿Cómo medimos la temperatura?
La temperatura es una magnitud estadística, por lo que no podemos medirla directamente. Para medirla hacemos uso de diversas magnitudes que varían con ella, como por ejemplo la altura de una columna de mercurio, la resistencia eléctrica o el volumen y la presión de un gas. A estas magnitudes, se las denomina magnitudes termométricas.
Escalas de temperatura
La temperatura se mide indirectamente a través de las magnitudes termométricas. Como vamos a ver, usaremos los valores de estas magnitudes en ciertos estados fijos para calibrar los termómetros, estableciendo, así, una escala. Ejemplos de estos estados fijos son la congelación o la ebullición del agua.
Existen tres grandes escalas para medir la temperatura:
- Celsius
- Farenheit
- KelviIN
Escalas Termométricas:
Una escala termométrica corresponde a un conjunto de valores numéricos donde cada uno de dichos valores se asocia a una temperatura.
Para graduar a las escalas se eligió, para puntos fijos, dos fenómenos que se reproducen siempre en las mismas condiciones: la fusión del hielo y la ebullición del agua, ambos bajo presión normal.
1er. Punto Fijo: corresponde a la temperatura de fusión del hielo, llamado punto del hielo.
2do. Punto Fijo:: corresponde a la temperatura de ebullición del agua, llamado punto de vapor.
El intervalo de 0ºC a 100ºC y de 273K a 373K está dividido en 100 partes iguales y cada una de las divisiones corresponde a 1ºC y 1K, respectivamente. En la escala Fahrenheit el intervalo de 32ºF a 212ºF está dividido en 180 partes.
La escala Fahrenheit es generalmente utilizada en los países de habla inglesa. La escala Kelvin es llamada escala absoluta de temperatura.
Ecuación Termométrica:
Donde: a y b son constantes y a ¹ 0.
G es la grandeza termométrica.
t es la temperatura.
A esa función denominamos ecuación termométrica.
Ejemplo: Transformar 35ºC en ºF.
El calor se define como la transferencia de energía térmica que se da entre diferentes cuerpos o diferentes zonas de un mismo cuerpo que se encuentran a distintas temperaturas, sin embargo en termodinámica generalmente el término calor significa transferencia de energía. Este flujo de energía siempre ocurre desde el cuerpo de mayor temperatura hacia el cuerpo de menor temperatura, ocurriendo la transferencia hasta que ambos cuerpos se encuentren en equilibrio térmico (ejemplo: una bebida fría dejada en una habitación se entibia).
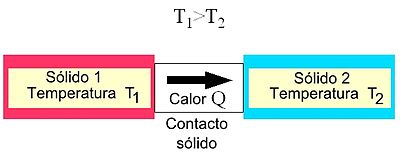 La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.
La energía calórica o térmica puede ser transferida por diferentes mecanismos de transferencia, estos son la radiación, la conducción y la convección, aunque en la mayoría de los procesos reales todos se encuentran presentes en mayor o menor grado. Cabe resaltar que los cuerpos no tienen calor, sino energía térmica. La energía existe en varias formas. En este caso nos enfocamos en el calor, que es el proceso mediante el cual la energía se puede transferir de un sistema a otro como resultado de la diferencia de temperatura.CANTIDAD DE CALOR
CALOR.- Se llama calor a la propagación o flujo de la energía entre cuerpos que se ponen en contacto, es decir, el calor es la energía en movimiento.
Todos los cuerpos de la naturaleza tienden a un estado final llamado equilibrio termodinámico con el medio que los rodea o con otros cuerpos en contacto, es decir adquieren la misma temperatura.
Capacidad Calorífica (C).- Se define como la cantidad de calor que se debe suministrar o sustraer a un cuerpo o sustancia para elevar o disminuir su temperatura en un grado centigrado, es decir.
 Siendo T0, T las temperaturas inicial y final respectivamente.
Siendo T0, T las temperaturas inicial y final respectivamente.
La capacidad calorífica es una cantidad física escalar que depende de la composición y estructura interna del cuerpo o sustancia, lo cual implica que cada cuerpo o sustancia tiene su propia capacidad calorífica.
Calor específico (Ce).- Se define como la cantidad de calor (Q), que se debe suministrar a la masa "m" de un cuerpo para elevar su temperatura en un grado centígrado.

Cantidad de calor (Q).- Se llama así, a la cantidad de calor que gana o pierde un cuerpo o sustancia al ponerse en contacto con otro cuerpo que se encuentra a diferente temperatura, cuya ecuación esta dado por:
 Siendo Ce. el calor especifico, "m" la masa y T, T0 las temperaturas inicial y final.
Siendo Ce. el calor especifico, "m" la masa y T, T0 las temperaturas inicial y final.




muy completo y didactico
ResponderBorrarExcelente presentacion: breve y sustancioso..
ResponderBorrarGran trabajo, me sirvió mucho la información, gracias
ResponderBorrar