TERMODINÁMICA
Procesos Termodinámicos
Si sobre un sistema se realiza un proceso termodinámico de modo tal que no haya intercambio de calor (energía) con el medio circundante, se lo denomina proceso adiabático. Este tipo de proceso tiene lugar si el sistema estuviera perfectamente aislado térmica mente o bien si se lo realiza suficientemente rápido como para que no haya tiempo suficiente para que se produzca un intercambio de calor con el medio circundante.
Si el sistema puede intercambiar energía con su medio y el proceso se realiza lentamente, de modo que el sistema tenga tiempo de entrar en equilibrio térmico con el medio circundante, el proceso es isotérmico. Cuando el proceso es intermedio entre estos dos extremos (adiabático e isotérmico) el proceso se denomina politrópico.
A presiones moderadas, P£3 bar, casi todos los gases pueden ser considerados como ideales ideales. Esto significa que, entre otras propiedades, ellos se comportan siguiendo la ecuación de estado:
P.V = n. R.T
donde, P es la presión absoluta del gas, V su volumen, T la temperatura absoluta, n el número de moles del gas y R la constante universal de los gases.
Es importante considerar que para estudiar las propiedades de un gas es crucial evitar la presencia de vapores (agua) en el mismo, ya que los vapores no siguen la misma ley. Cuando a un gas se lo somete a distintos procesos termodinámicos, el mismo sigue trayectorias en un diagrama PV que son características del tipo de proceso al que es sometido.
EQUILIBRIO TÉRMICO
Si en el universo se alcanzara el equilibrio y existiera en todos los lugares la misma temperatura eso supondría la muerte, la quietud, la falta de cambio.
 Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2 ....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos"equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.
Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2 ....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos"equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.

Vamos a comprobarlo
Calentamos en un tubo de ensayo 25 ml H2O (agua) hasta una temperatura alta. Lo introducimos centrado en un vaso de precipitados mas grande que contiene 100 ml de agua. Medimos las temperaturas de los dos a intervalos de un minuto.
Agitamos el tubo de ensayo para homogeneizar la temperatura dentro y fuera y mantenemos la sonda externa alejada del tubo de ensayo.
Registramos los datos, los anotamos en una tabla y registramos gráficamente las temperaturas de cada uno frente al tiempo.
En nuestro caso el registro lo hizo el aparato electrónico y la gráfica nos la dio el mismo aparato, pero disponiendo de dos termómetros podemos anotar los datos y luego hacer la gráfica.
Los recursos electrónicos nos permiten hacer más rápidas y más bonitas las gráficas, pero los conceptos que se descubren se pueden obtener igualmente aunque no dispongamos de tantos recursos.
ENERGÍA INTERNA
La magnitud que designa la energía almacenada por un sistema de partículas se denomina energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular debida a las fuerzas de tipo gravitatorio, electromagnético y nuclear.
La energía interna es una función de estado: su variación entre dos estados es independiente de la transformación que los conecte, sólo depende del estado inicial y del estado final.

Como consecuencia de ello, la variación de energía interna en un ciclo es siempre nula, ya que el estado inicial y el final coinciden:
 La U es el símbolo común mas usado para representar la energía interna.
La U es el símbolo común mas usado para representar la energía interna.
Si sobre un sistema se realiza un proceso termodinámico de modo tal que no haya intercambio de calor (energía) con el medio circundante, se lo denomina proceso adiabático. Este tipo de proceso tiene lugar si el sistema estuviera perfectamente aislado térmica mente o bien si se lo realiza suficientemente rápido como para que no haya tiempo suficiente para que se produzca un intercambio de calor con el medio circundante.
Si el sistema puede intercambiar energía con su medio y el proceso se realiza lentamente, de modo que el sistema tenga tiempo de entrar en equilibrio térmico con el medio circundante, el proceso es isotérmico. Cuando el proceso es intermedio entre estos dos extremos (adiabático e isotérmico) el proceso se denomina politrópico.
A presiones moderadas, P£3 bar, casi todos los gases pueden ser considerados como ideales ideales. Esto significa que, entre otras propiedades, ellos se comportan siguiendo la ecuación de estado:
P.V = n. R.T
donde, P es la presión absoluta del gas, V su volumen, T la temperatura absoluta, n el número de moles del gas y R la constante universal de los gases.
Es importante considerar que para estudiar las propiedades de un gas es crucial evitar la presencia de vapores (agua) en el mismo, ya que los vapores no siguen la misma ley. Cuando a un gas se lo somete a distintos procesos termodinámicos, el mismo sigue trayectorias en un diagrama PV que son características del tipo de proceso al que es sometido.
EQUILIBRIO TÉRMICO
Si en el universo se alcanzara el equilibrio y existiera en todos los lugares la misma temperatura eso supondría la muerte, la quietud, la falta de cambio.
Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2 ....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos"equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.
Vamos a comprobarlo
Calentamos en un tubo de ensayo 25 ml H2O (agua) hasta una temperatura alta. Lo introducimos centrado en un vaso de precipitados mas grande que contiene 100 ml de agua. Medimos las temperaturas de los dos a intervalos de un minuto.
Agitamos el tubo de ensayo para homogeneizar la temperatura dentro y fuera y mantenemos la sonda externa alejada del tubo de ensayo.
Registramos los datos, los anotamos en una tabla y registramos gráficamente las temperaturas de cada uno frente al tiempo.
En nuestro caso el registro lo hizo el aparato electrónico y la gráfica nos la dio el mismo aparato, pero disponiendo de dos termómetros podemos anotar los datos y luego hacer la gráfica.
Los recursos electrónicos nos permiten hacer más rápidas y más bonitas las gráficas, pero los conceptos que se descubren se pueden obtener igualmente aunque no dispongamos de tantos recursos.
ENERGÍA INTERNA
La magnitud que designa la energía almacenada por un sistema de partículas se denomina energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular debida a las fuerzas de tipo gravitatorio, electromagnético y nuclear.
La energía interna es una función de estado: su variación entre dos estados es independiente de la transformación que los conecte, sólo depende del estado inicial y del estado final.
Como consecuencia de ello, la variación de energía interna en un ciclo es siempre nula, ya que el estado inicial y el final coinciden:
La U es el símbolo común mas usado para representar la energía interna.
Ejemplo de Energía Interna

Cuando se calientan ambas muestras de agua y de cobre 1°C, la adición proporcionada a sus energías cinéticas es la misma en ambos casos, puesto que eso es lo que mide la temperatura. Pero para conseguir este incremento en el agua, se le debe añadir a la parte de energía potencial de la energía interna, una proporción de energía mucho mas grande. De modo que la energía total necesaria para aumentar la temperatura del agua es mucho mas grande, o sea; su calor específico es mayor.
Transmisión del calor
El calor se transmite de un lugar a otro de tres maneras diferentes:Introducción
- Por conducción entre cuerpo sólidos en contacto
- Por convección en fluidos (líquidos o gases)
- Por radiación a través del medio en que la radiación pueda propagarse
La energía se transmite de la forma que resulta más eficiente.
Vamos a ver unos ejemplos de transmisión de calor
Ejemplo 1
Placa solar
El calor llega desde el Sol hasta la placa metálica por radiación. El metal de la placa emite radiación en el infrarrojo

.
El calor se transmite al líquido que está en contacto con la placa por conducción.
En el líquido se establecen corrientes covectivas que lo mezclan y uniformizan el calor. El agua caliente sube y la fría baja.
El agua más caliente sube al depósito superior y de la parte inferior de este depósito baja el agua más fría que entra por la parte de abajo de la placa
Con esta sencilla placa, y dependiendo de la radiación solar, se alcanzan temperaturas muy altas. Probablemente hayas visto estas placas en los tejados de algunas casas. Busca en la red "placas solares"
Cambios de estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas (si se descarta lamateria oscura).
Cambios de estado de agregación de la materia
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:

- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.

- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso.

- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.

- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.

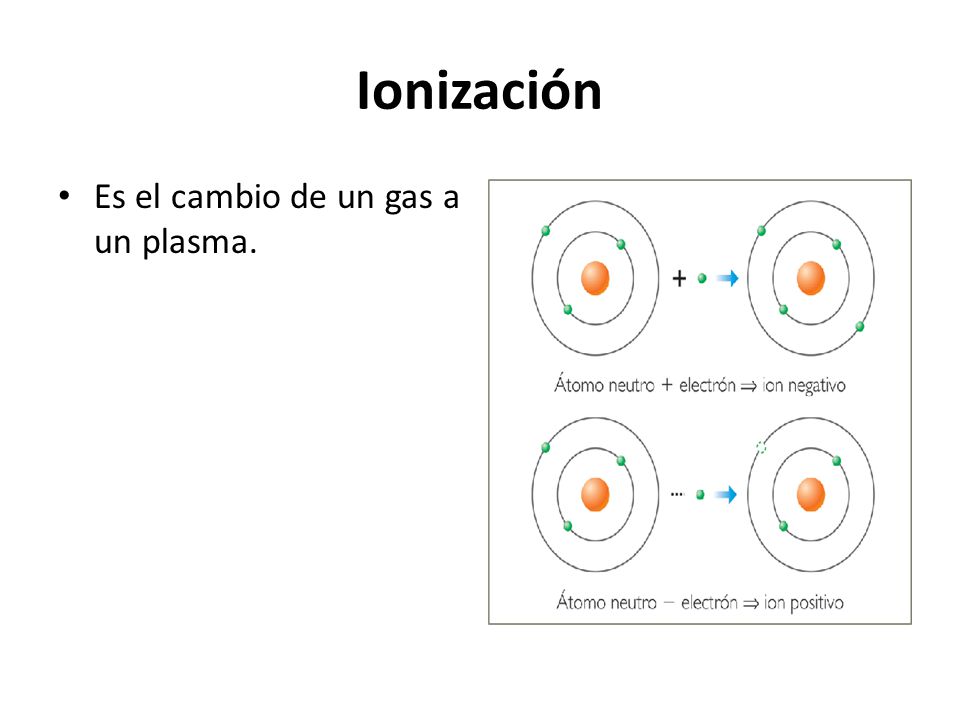
- Ionización: Es el cambio de un gas a un plasma.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.
 La siguiente tabla indica cómo se denominan los cambios de estado:
La siguiente tabla indica cómo se denominan los cambios de estado:
Inicial\Final Sólido Líquido Gas Sólido fusión sublimación, sublimación progresiva o sublimación directa Líquido solidificación evaporación o ebullición Gas sublimación inversa, regresiva o deposición condensación y licuefacción (licuación)
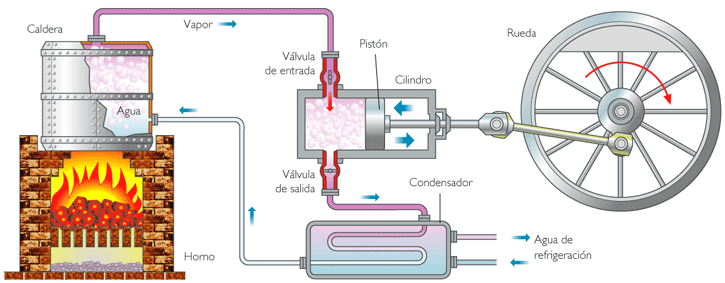
MAQUINAS TÉRMICAS
Una máquina térmica es un dispositivo que realiza un trabajo mediante un proceso de paso de energía desde un foco caliente hasta un foco frío.
Las máquinas térmicas o motores térmicos aprovechan una fuente de energía para realizar un trabajo mecánico. La energía transferida como calor a la máquina no puede a su vez ser transferida íntegramente por esta como trabajo: una parte de la energía debe ser transferida como calor.
por ello las máquinas térmicas constan de dos partes:
- Un foco caliente, que cede energía a la máquina mediante calor.
- Un foco frío, que recibe energía de le máquina también mediante calor.
Cuando se calientan ambas muestras de agua y de cobre 1°C, la adición proporcionada a sus energías cinéticas es la misma en ambos casos, puesto que eso es lo que mide la temperatura. Pero para conseguir este incremento en el agua, se le debe añadir a la parte de energía potencial de la energía interna, una proporción de energía mucho mas grande. De modo que la energía total necesaria para aumentar la temperatura del agua es mucho mas grande, o sea; su calor específico es mayor.
Transmisión del calor
- Por conducción entre cuerpo sólidos en contacto
- Por convección en fluidos (líquidos o gases)
- Por radiación a través del medio en que la radiación pueda propagarse
La energía se transmite de la forma que resulta más eficiente.
Vamos a ver unos ejemplos de transmisión de calor
Ejemplo 1
Placa solar
El calor llega desde el Sol hasta la placa metálica por radiación. El metal de la placa emite radiación en el infrarrojo
| . El calor se transmite al líquido que está en contacto con la placa por conducción. En el líquido se establecen corrientes covectivas que lo mezclan y uniformizan el calor. El agua caliente sube y la fría baja. El agua más caliente sube al depósito superior y de la parte inferior de este depósito baja el agua más fría que entra por la parte de abajo de la placa |
Con esta sencilla placa, y dependiendo de la radiación solar, se alcanzan temperaturas muy altas. Probablemente hayas visto estas placas en los tejados de algunas casas. Busca en la red "placas solares"
Cambios de estado
En física y química se denomina cambio de estado a la evolución de la materia entre varios estados de agregación sin que ocurra un cambio en su composición. Los tres estados más estudiados y comunes en la Tierra son el sólido, el líquido y el gaseoso; no obstante, el estado de agregación más común en el Universo es el plasma, material del que están compuestas las estrellas (si se descarta lamateria oscura).
Cambios de estado de agregación de la materia
Son los procesos en los que un estado de la materia cambia a otro manteniendo una semejanza en su composición. A continuación se describen los diferentes cambios de estado o transformaciones de fase de la materia:
- Fusión: Es el paso de un sólido al estado líquido por medio del calor; durante este proceso endotérmico (proceso que absorbe energía para llevarse a cabo este cambio) hay un punto en que la temperatura permanece constante. El "punto de fusión" es la temperatura a la cual el sólido se funde, por lo que su valor es particular para cada sustancia. Dichas moléculas se moverán en una forma independiente, transformándose en un líquido. Un ejemplo podría ser un hielo derritiéndose, pues pasa de estado sólido al líquido.
- Solidificación: Es el paso de un líquido a sólido por medio del enfriamiento; el proceso es exotérmico. El "punto de solidificación" o de congelación es la temperatura a la cual el líquido se solidifica y permanece constante durante el cambio, y coincide con el punto de fusión si se realiza de forma lenta (reversible); su valor es también específico.
- Vaporización y ebullición: Son los procesos físicos en los que un líquido pasa a estado gaseoso. Si se realiza cuando la temperatura de la totalidad del líquido iguala al punto de ebullición del líquido a esa presión continuar calentándose el líquido, éste absorbe el calor, pero sin aumentar la temperatura: el calor se emplea en la conversión del agua en estado líquido en agua en estado gaseoso, hasta que la totalidad de la masa pasa al estado gaseoso.
- Condensación: Se denomina condensación al cambio de estado de la materia que se pasa de forma gaseosa a forma líquida. Es el proceso inverso a la vaporización. Si se produce un paso de estado gaseoso a estado sólido de manera directa, el proceso es llamado sublimación inversa. Si se produce un paso del estado líquido a sólido se denomina solidificación.


- Sublimación: Es el proceso que consiste en el cambio de estado de la materia sólida al estado gaseoso sin pasar por el estado líquido. Al proceso inverso se le denomina Sublimación inversa; es decir, el paso directo del estado gaseoso al estado sólido. Un ejemplo clásico de sustancia capaz de sublimarse es el hielo seco.

- Ionización: Es el cambio de un gas a un plasma.
Es importante hacer notar que en todas las transformaciones de fase de las sustancias, éstas no se transforman en otras sustancias, solo cambia su estado físico.

La siguiente tabla indica cómo se denominan los cambios de estado:
| Inicial\Final | Sólido | Líquido | Gas |
|---|---|---|---|
| Sólido | fusión | sublimación, sublimación progresiva o sublimación directa | |
| Líquido | solidificación | evaporación o ebullición | |
| Gas | sublimación inversa, regresiva o deposición | condensación y licuefacción (licuación) |
MAQUINAS TÉRMICAS
Una máquina térmica es un dispositivo que realiza un trabajo mediante un proceso de paso de energía desde un foco caliente hasta un foco frío.
Las máquinas térmicas o motores térmicos aprovechan una fuente de energía para realizar un trabajo mecánico. La energía transferida como calor a la máquina no puede a su vez ser transferida íntegramente por esta como trabajo: una parte de la energía debe ser transferida como calor.
por ello las máquinas térmicas constan de dos partes:
- Un foco caliente, que cede energía a la máquina mediante calor.
- Un foco frío, que recibe energía de le máquina también mediante calor.

No hay comentarios.:
Publicar un comentario