Si sobre un sistema se realiza un proceso termodinámico de modo tal que no haya intercambio de calor (energía) con el medio circundante, se lo denomina proceso adiabático. Este tipo de proceso tiene lugar si el sistema estuviera perfectamente aislado térmica mente o bien si se lo realiza suficientemente rápido como para que no haya tiempo suficiente para que se produzca un intercambio de calor con el medio circundante.
Si el sistema puede intercambiar energía con su medio y el proceso se realiza lentamente, de modo que el sistema tenga tiempo de entrar en equilibrio térmico con el medio circundante, el proceso es isotérmico. Cuando el proceso es intermedio entre estos dos extremos (adiabático e isotérmico) el proceso se denomina politrópico.
A presiones moderadas, P£3 bar, casi todos los gases pueden ser considerados como ideales ideales. Esto significa que, entre otras propiedades, ellos se comportan siguiendo la ecuación de estado:
P.V = n. R.T
donde, P es la presión absoluta del gas, V su volumen, T la temperatura absoluta, n el número de moles del gas y R la constante universal de los gases.
Es importante considerar que para estudiar las propiedades de un gas es crucial evitar la presencia de vapores (agua) en el mismo, ya que los vapores no siguen la misma ley. Cuando a un gas se lo somete a distintos procesos termodinámicos, el mismo sigue trayectorias en un diagrama PV que son características del tipo de proceso al que es sometido.
EQUILIBRIO TÉRMICO
Si en el universo se alcanzara el equilibrio y existiera en todos los lugares la misma temperatura eso supondría la muerte, la quietud, la falta de cambio.
Todos los cuerpos tienen una energía llamada energía interna. La cantidad de energía interna de un cuerpo es muy difícil de establecer ya que las partículas que forman un cuerpo tienen energías muy variadas. Tienen energías de tipo eléctrico, de rotación, de traslación y vibración debido a los movimientos que poseen, energías de enlace (que pueden dar posibles reacciones químicas) e incluso energía al desaparecer la materia y transformarse en energía DE=mc2 ....
Lo más fácil de medir es la variación de energía en un proceso de transformación concreto y si el proceso es sólo físico mucho mejor. (Ejemplos: calentamiento, cambios de estado...).
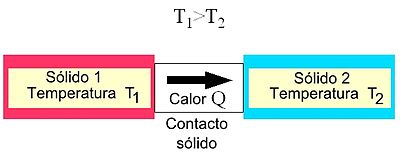
Al poner en contacto dos cuerpos a distinta temperatura, el de mayor temperatura cede parte de su energía al de menos temperatura hasta que sus temperaturas se igualan. Se alcanza así lo que llamamos"equilibrio térmico".
La energía calorífica (calor) no pasa del cuerpo que tiene más energía al que tiene menos sino del que tiene mayor temperatura al que la tiene menor.
Con el siguiente ejemplo aclaramos la anterior afirmación
El calor fluye desde los cuerpos que están a más temperatura a los que están a temperatura menor.

Vamos a comprobarlo
Calentamos en un tubo de ensayo 25 ml H2O (agua) hasta una temperatura alta. Lo introducimos centrado en un vaso de precipitados mas grande que contiene 100 ml de agua. Medimos las temperaturas de los dos a intervalos de un minuto.
Agitamos el tubo de ensayo para homogeneizar la temperatura dentro y fuera y mantenemos la sonda externa alejada del tubo de ensayo.
Registramos los datos, los anotamos en una tabla y registramos gráficamente las temperaturas de cada uno frente al tiempo.
En nuestro caso el registro lo hizo el aparato electrónico y la gráfica nos la dio el mismo aparato, pero disponiendo de dos termómetros podemos anotar los datos y luego hacer la gráfica.
Los recursos electrónicos nos permiten hacer más rápidas y más bonitas las gráficas, pero los conceptos que se descubren se pueden obtener igualmente aunque no dispongamos de tantos recursos.
ENERGÍA INTERNA
La magnitud que designa la
energía almacenada por un sistema de partículas se denomina
energía interna (U). La energía interna es el resultado de la contribución de la energía cinética de las moléculas o átomos que lo constituyen, de sus energías de rotación, traslación y vibración, además de la energía potencial intermolecular debida a las fuerzas de tipo gravitatorio, electromagnético y nuclear.
La energía interna es una
función de estado: su variación entre dos estados es independiente de la transformación que los conecte, sólo depende del estado inicial y del estado final.

Como consecuencia de ello, la variación de energía interna en un ciclo es siempre nula, ya que el estado inicial y el final coinciden:

La U es el símbolo común mas usado para representar la energía interna.